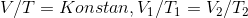- Pendahuluan
Dalam
termodinamika yang sering menjadi perhatian adalah suatu keadaan gas, pembahasan
tersebut sering diberikan dalam bentuk gas yang bersifat makroskopis dan mikroskopis, dalam situasi
yang ada secara fisis dikenal system dan lingkungan. Segala sesuatu diluar
system tersebut mempunyai pengaruh langsung kepada sifat system [1].
Sifat makroskopis suatu gas
merupakan suatu sifat atau keadaan gas yang dapat diukur dan diamati, seperti suhu,
tekanan dan volume suatu gas sedangkan sifat mikroskopis suatu gas merupakan
suatu sifat atau keadaan gas yang tidak dapat diamati dan diukur seperti
kelajuan partikel gas, massa penyusun inti partikel, momentum suatu gas [2].
Persamaan gas ada 2 (dua) yaitu persamaan gas ideal dan
persamaan gas Van Der Waals, persamaan ini berfungsi untuk mendeskripsikan
suatu sifat dan keadaan suatu gas.
Pada
persamaan gas ideal dapat dituliskan secara matematis :
 (1)
(1)
Dalam
kehidupan yang nyata, tidak pernah ditemukan gas dalam keadaan ideal atau gas
ideal karena sulit diamati, tetapi kita sering memandangnya sebagai gas ideal.
Dalam hal ini sifat- sifat gas dalam tekanan
dan suhu kamar sifat gas mendekati sifat gas ideal dan dianggap sebagai
gas ideal. Namun seorang ilmuwan asal belanda yang bernama Johannes D. Van Der
Waals memperlajari dan mengamati suatu gas serta membuat persamaan gas nyata
pada suatu keadaan tertentu. Model Van Der Waals adalah model yang paling mendekati sifat
kenyataan suatu gas serta sifat suatu gas yang paling mudah dideskripsikan.
Model gas
Van Der Walls mengandung dua hal pembahasan yang penting yakni, interaksi antar
molekul-molekul yang bertumbukan setiap saat dan gas memiliki suatu massa atau
tidak sama dengan nol [3]. Persamaan gas Van Der Waals dapat dituliskan.
 (2)
(2)
Hal itu
menunjukkan bahwa massa gas pada persamaan
gas ideal dipandang nol. Dalam interaksi
gas di suatu wadah menimbulkan pertambahan volume gas tersebut dari
volume 1 ke volume 2, penambahan volume tersebut dapat dipandang sebagai usaha
yang dilakukan oleh gas terhadap wadah wadah [4], persamaan usaha dapat
dituliskan :
 (3)
(3)
Usaha yang
dilakukan oleh suatu system bernilai positif, sedangkan usaha yang dilakukan
pada system bernilai negative [5]. Tekanan (P), temperature (T) dan volume (V)
merupakan suatu parameter keadaan[5].
1.l Tujuan
eksperimen
· Melakukan pencocokan kurva (kurva fitting) terhadap grafik hasil
eksperimen dan melakukan analisa.
· Mendeskripsikan antara tekanan
dan volume gas dalam bentuk kalimat dan persamaan matematis.
· Mendeskribsikan antara tekanan
dan suhu gas dalam bentuk kalimat dan persamaan matematis.
1.2 Rumusan
masalah
·
Apakah kurva terhadap grafik
sama dengan Analisa.
·
Bagaimana hubungan tekanan dan
volume gas.
·
Bagaimana hubungan tekanan dan
suhu gas.
1.3 Dasar
teori
1. Hukum Boyle
Seorang
ilmuwan yang menyelidiki hubungan volume dengan tekanan gas adalah Robert
Boyle (1627 - 1691). Boyle telah menyelidiki hubungan tekanan dan
volume gas dalam wadah tertutup pada temperatur tetap. Boyle menemukan bahwa : hasil
kali tekanan dan volume gas pada temperatur tetap adalah konstan. Hukum ini dikenal sebagai Hukum
Boyle. Secara matematis, Hukum Boyle dituliskan dalam bentuk :

(
4)
Keterangan :
P1 = tekanan gas awal (N/m)
V1
= volume gas awal (m)
P2
= tekanan gas akhir (N/m)
V2
= volume gas akhir (m)
Dari
persamaan Hukum Boyle tersebut, hubungan tekanan dan volume pada temperatur tetap dapat
digambarkan dalam bentuk grafik seperti pada gambar berikut.
Gambar 1. Grafik hubungan tekanan dan volume pada temperatur tetap
2.
Hukum Charles
Berdasarkan
penyelidikannya, Jacques Charles (1747- 1823) menemukan bahwa : Volume gas berbanding lurus dengan
temperatur mutlaknya, jika tekanan gas di dalam ruang tertutup dijaga konstan. Pernyataan Charles ini dikenal
sebagai Hukum Charles dan dituliskan dalam bentuk persamaan :
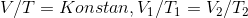
(5)
Keterangan :
T1 = temperatur mutlak awal
(K)
V1 = volume gas awal (m)
T2 = temperatur mutlak
akhir (K)
V2 = volume gas akhir (m)
Hubungan
temperatur dan volume menurut Hukum Charles tersebut dapat digambarkan dalam bentuk
grafik, seperti gambar 2 berikut.
Gambar.2. Grafik hubungan volume dan temperatur pada tekanan tetap.
Jika
digambarkan sampai temperatur rendah, grafik akan memotong sumbu di sekitar
-273 °C atau 0 °K. Ini menunjukkan bahwa semua gas jika dapat didinginkan sampai volume
-273 °C, maka volumenya akan nol. Grafik ini dapat berlaku untuk semua jenis
gas. Semua jenis gas tidak dapat didinginkan lagi, hingga temperaturnya kurang
dari -273 °C. Ini berarti temperatur -273 °C atau 0 ̊K merupakan suhu terendah yang dapat dicapai gas. Temperatur ini disebut
temperatur nol mutlak. Nol mutlak merupakan dasar bagi skala temperatur
yang dikenal sebagai skala mutlak atau skala Kelvin. Pada skala ini, temperatur
dinyatakan dalam Kelvin (K).
3.Hukum
Gay Lussac
Seorang
ilmuwan bernama Joseph Gay Lussac, telah menyelidiki hubungan
tekanan dan temperatur gas pada volume tetap. Gay Lussac menyatakan: Jika volume gas pada ruang
tertutup dibuat tetap, maka tekanan gas berbanding lurus dengan temperatur gas.
Pernyataan
ini disebut Hukum Gay Lussac yang dituliskan dalam bentuk persamaan
berikut:

(6)
Persamaan
tersebut dapat dinyatakan dalam bentuk grafik seperti gambar 3 dibawah ini.
Gb.3. Grafik hubungan tekanan dan temperatur pada volume tetap
4. Hukum Boyle - Gay Lussac
Ketiga
hukum keadaan gas yaitu hukum Boyle, hukum Charles, dan hukum Gay Lussac
dapat digabungkan menjadi satu persamaan. Hasil gabungan ketiga hukum tersebut
dikenal sebagai hokum Boyle - Gay Lussac. Hukum ini dinyatakan dalam
bentuk persamaan :

(
7)
Keterangan:
N = jumlah molekul gas
NA
= bilangan Avogadro (6,02 x 1023molekul/mol)
n = jumlah mol gas
k = konstanta Boltzman (1,38 x 10-23J/K)
Pada
persamaan tersebut, NA k disebut dengan konstanta gas umum (R). Jadi, persamaan gas tersebut
dapat diubah menjadi :

(8)
Keterangan
:
R =
konstanta gas umum (8,314 J/mol ̊K atau 0,082 L atm/mol ̊K)
5. Hukum Van der Waals
Ilmuan asal Belanda bernama Johannes D. Van der Waals yang membuat persamaan gas nyata. Beliau menggunakan model sifat gas nyata yang paling sering dan paling mudah digunakan, karena mengandung dua hal krusial pada gas, yaitu antar molekul dan ukuran molekul-molekul gas yang tak nol. Menurut Socrates, persamaan van der Waals (masih) tidak mereproduksi sifat-sifat gas yang nyata, tetapi persamaan tersebut adalah peningkatan yang baik dari persamaan gas ideal. Usaha yang yang dilakukan oleh sistem bernilai positif, sedangkan usaha yang dilakukan pada sistem bernilai negatif. Berikut persamaan van der Waals secara matematis dapat dituliskan :

(9)
Konstanta
a mengukur kekuatan interaksi antar molekul, sedangkan konstanta b mengukur
volume yang dikeluarkan berhubungan dengan ukuran molekul yang terbatas, tidak
berhingga (konstanta b berhubungan dengan perubahan volume), dan gaya antar
molekul pada gas menurunkan tekanan, sehingga tekanan berada di bawah nilai
yang diharapkan oleh gas ideal (aV2 memainkan peran ini).
II. Metodologi
Penelitian
dilakukan dilaboratorium Fisika UKSW pukul 11.00-13.00 WIB, pada tanggal 23 dan
25 November 2017. Dalam penelitian ini terbagi atas dua bagian, yakni
menganalisis keterkaitan antara volume
terhadap tekanan dan keterkaitan antara suhu terhadap tekanan.
Untuk
menganalisis keterkaitan antaran volume dengan tekanan gas, maka volume dibuat
sebagai variable bebas yang di buat berubah-ubah dari volume 5 ml sampai 20 ml dengan interval yang diberikan 1 ml. Kemudian
data yang didapatkan dilakukan pencocokan kurva (curve fitting) terhadap grafik hasil dari eksperimen, kemudian
hasil tersebut dianalisa untuk melakukan pencocokan.
Kemudian
untuk menganalisis keterkaitan antara suhu dengan tekanan, suhu gas dibuat
sebagai variable bebas dengan cara memanaskan gelas beker yang berisi air dan
gelas elenmenyer yang berisi gas (udara). Dapat dipandang bahwa suhu air
tersebut sama dengan suhu gas (udara ) dalam wadah elenmenyer. Dalam analisis
keterkaitan suhu dengan tekanan diambil dari suhu keadaan normal atau suhu kamar sampai dengan suhu
maksimal. Dari kedua Analisa diatas semua data diambil dengan bantuan aplikasi
data logger-pro.
2.1
Alat
·
Computer
yang terinstal logger-pro
·
Suntikan
·
Intervace
varnier
·
Sensor
tekanan varnier
·
Sensor
suhu varnier
·
Penyangga
·
Gelas
ukur
·
Gelas
elenmenyer
·
Spritus
·
kassa
2.2
Bahan
·
Air
·
Pemantik api
2.3
Skema
SUNTIKAN
SENSOR TEKANAN - KOMPUTER
INTERVACE VARNIER
Gb.4. Skema persiapan pemasangan alat
dan bahan tekanan terhadap volume (klep karet hitam pada suntikan mula-mula
pada posisi 10 ml)
ALAT PENGUKUR
SENSOR SUHU VANIER-GELAS UKUR-GELAS ABU
KOMPUTER
INTERFACE VANIER
SENSOR TEKANAN VANIER
Gb.5. Skema persiapan dan pemasangan alat dan bahan pada tekanan terhadap suhu ( tabung elenmenyer dipastikan tetutup rapat)
3 Langkah-langkah percobaan
a.
Hubungan tekanan dan volume
1.
Menyiapkan alat dan bahan yang digunakan sesuai dengan skema.
Catatan; posisi klep karet
hitam yang ada di suntikan berada pada posisi 10 ml sebelum dihubungkan dengan
pada sensor tekanan varnier.
2. ( gambar on) mengklik tombol seperti (gambar) untuk
memulai pengambilan data.
3. Medorong klep karet hitam
dari posisi semula ke posisi 5 ml, serta mempertahankan posisinya agar stabil.
4.
Klep karet hitam pada
suntikan ditarik dengan interval 1ml ke posisi 6 ml, sehingga dapat terbaca
dikomputer.
Catatan: klep dipertahankan agar stabil diposisi yang ditunjuk pada
suntikan.
5.
Melakukan langkah pada
langkah (4) untuk pengukuran hingga 20 ml dengan interval 1ml.
6. (gambar off)
mengklik ketika selesai mengambil data.
7.
Melakukan pencocokan kurva dengan
hasil grafik yang didapatkan.
b.
Hubungan tekanan dan volume
1.
Menyiapkan alat dan bahan yang digunakan sesuai dengan skema
Catatan;mula-mula
elenmenyer ditutup rapat agar tidak ada udara yang keluar masuk.
2. (gambar on)mengklik
tombol seperti gambar yang terlihat pada desktop computer untuk memulai
pengambilan data
3. Mengamati setiap kenaikan suhu terhadap system hingga pada saat suhu
maksimal.
Catatan; hingga air
mendidih tekanan pada tabung elenmenyer tidak mengalami penurunan.
4. (gambar off ) mengklik tombol tersebut ketika sudah selesai
pengambilan data.
5.
Melakukan pencocokkan kurva
dengan hasil grafik yang didapatkan.
III. hasil dan pembahasan
3.1 Hubungan tekanan dengan volume
berdasarkan hasil
pengumpulan data yang dilakukan sebanyak 1 kali maka diperoleh hasil seperti
yang ditunjukkan pada tabel.
Tabel 1. Keterkaitan antara tekanan dan volume
dari udara lingkungan.
Keadaan ke-N
|
Volume (L)
|
Tekanan (Pa)
|
1
|
0,005
|
177983,9716
|
2
|
0,006
|
153334,6129
|
3
|
0,007
|
135482,7646
|
4
|
0,008
|
119528,5382
|
5
|
0,009
|
106040,0367
|
6
|
0,010
|
95758,95019
|
7
|
0,011
|
86180,10209
|
8
|
0,012
|
80933,0395
|
9
|
0,013
|
75516,33504
|
10
|
0,014
|
70127,2467
|
11
|
0,015
|
64154,27469
|
12
|
0,016
|
61226,96609
|
13
|
0,017
|
57573,74808
|
14
|
0,018
|
54863,42327
|
15
|
0,019
|
51190,47945
|
16
|
0,020
|
49916,19282
|
Dimana
tekanan pada tabel 1 merupakan hasil pembacaan tekanan pada logger pro. Pola
perubahan tekanan terhadap volume yang ditunjukkan pada gambar 6
Gb.6. Pola perubahan tekanan terhadap volume
Berdasarkan
gambar gambar 6 yang diambil dari pada
tabel 1 menunjukkan kurva grafik tekanan terhadap volume. maka dapat dilihat penyebaran data mendekati suatu keadaan gas
nyata
Persamaaan
pada Gb. 6 adalah
 (10)
(10)
Dengan nilai 
Berdasarkan
persamaan (2) dan persamaan (8) nilai A menunjukkan bahwa :
 (11)
(11)
Keterangan:
n = Jumlah mol gas
R = Konstanta gas (8,314
J/mol ̊K atau 0,082
L atm/mol ̊K)
T = Suhu (K)
Sedangkan nilai dari B menunjukkan factor
pengurang atau koreksi karena volume partikel (L)
Maka nilai B adalah
 (12)
(12)
Keterangan :
B = volume
setiap gas mol
Sedangkan
nilai dari C adalah
 (13)
(13)
Nilai dari a
dan b merupakan sebuah konstatan yakni konstatan Van Der Waals yang nilainya didapatkan
melalui eksperimen.
Untuk
menentukanan suhu dalam system apakah berubah, yang pertama dilakukan adalah
melihat jumlah mol dalam suatu system, apakah benar benar system dalam keadaan
terisolasi atau ada pertukaran massa gas.
Jumlah mol pada keadaan Room Temperature
and Pressure (RTP) dapat
ditentukan dengan persamaan :
 (14)
(14)
Volume RTP adalah volume ketika awal dari system yang diberikan,
dimana pada keadaan RTP, sebesar 0,01 L(10 mL).
 (15)
(15)
Pada persamaan (11) dan
persamaan (12), dapat diperoleh besar suhu yang berkerja pada system, yang
nilainya ditunjukkan dibawah ini;
 (16)
(16)
Maka nilai T, didapatkan

Nilai ralat suhu dalam
system tersebut
 (17)
(17)
Maka nilai ralat suhu kita dapatkan sebesar
Hal ini membuktikan bahwa suhu didalam system termasuk
dalam keadaan kosntan
 (18)
(18)
Secara praktis didapatkan suhu ruangan ketika
melakukan penelitian sebesar  ,maka
berdasarkan persamaan (11) pratikan menghitung jumlah mol dalam system dengan
perhitungan sebagai berikut;
,maka
berdasarkan persamaan (11) pratikan menghitung jumlah mol dalam system dengan
perhitungan sebagai berikut;
 (19)
(19)
Berdasarkan persamaan (10) dan persamaan (19)
maka diperoleh nilai b dari persamaan yang ada sebagai berikut
 (20)
(20)
Nilai ralat dalam suatu system
 (21)
(21)
Berdasarkan
persamaan (10) dan persamaan (17) didapatkan nilai dari a dengan perhitungan
dibawah ini;
 (22)
(22)
Maka nilai
ralat a
 (23)
(23)
Dengan
demikian dapat disimpulkan bahwa hubungan volume terhadap tekanan adalah
berbanding terbalik, yang secara matematis dapa dituliskan :
 (24)
(24)
Nilai dalam
ekperimen adalah : 
Dengan nilai
konstanta Van Der Waals untuk gas (udara) adalah;
 (25)
(25)
 (26)
(26)
3.2
Hubungan tekanan dengan suhu
Berdasarkan hasil pengumpulan
data sebanyak 1 kali percobaan
diperoleh hasil seperti pada tabel 2.
Tabel 2. Keterkaitan antara tekanan dan suhu dari
udara lingkungan.
|
|
Temperatur (K)
|
Tekanan (Pa)
|
1
|
298,7
|
96180
|
2
|
303
|
96870
|
3
|
308
|
97860
|
4
|
313
|
98730
|
5
|
318
|
99740
|
6
|
323
|
100770
|
7
|
328
|
101950
|
8
|
333
|
103030
|
9
|
338
|
104210
|
10
|
343
|
105400
|
11
|
348
|
106680
|
12
|
352
|
107800
|
Dimana tekanan pada pada tabel 2 merupakan hasil pembacaan tekanan
pada loger pro.
Pola perubahan tekanan terhadap suhu ditunjukkan oleh gambar 2
Gb 7. Pola perubahan tekanan terhadap suhu
Berdasarkan gambar
ditunjukkan bahwa sebaran data membentuk grafik linear sehingga
persamaan dapat dituliskan;
 Pa (27)
Pa (27)
Berdasarkan persamaan (10) dan (28) maka:
 (28)
(28)
 (29)
(29)
Dengan demikian dapat di simpulkan bahwa
hubungan suhu terhadap tekanan berbanding lurus secara linear, secara
sistematis dapat ditulis sebagai berikut :
 (30)
(30)
Nilai dalam eksperimen adalah :
 (31)
(31)
IV. kesimpulan
Dalam
penelitian kali ini dapat disimpulkan bahwa :
1. Dari hasil eksperimen menganalisis keterkaitan
volume dan suhu terhadap tekanan melalui data
yang diperoleh akan menunjukkan hasil kurva yang sesuai.
2.
Hubungan antara volume gas terhadap tekanan gas
berbanding terbalik
 .
.
3.
Hubungan antaran temperature (suhu) terhadap
tekanan gas berbanding lurus
 .
.
Saran dalam
pratikum kali ini eksperimen harus dilakukan secara hati-hati serta memastikan
semua alat tersambung sesuai skema yang telah ditentukan.
daftar pustaka
[1] Stephen
J. Blundell, Katherine M.Blundell, Concepts
in Thermal Physics, Second Edition, Oxford University Press, 2010.
[2] Halliday & Resnick, Fisika/termodinamika,
edisi
Ketiga,1984
[3] G.Socrates,Thermodynamics and Statistical Mechanics, Butterworths, 1971
[4] Young &
Freedman, Fisika
Universitas/Termodinamika, edisi kesepuluh,2001
 dan
dan  ialah massa masing-masing materi, r adalah jarak antara kedua materi dan G ialah tetapan yang universal yang dinamakan tetapan gravitasi, yang ternyata besarnya
ialah massa masing-masing materi, r adalah jarak antara kedua materi dan G ialah tetapan yang universal yang dinamakan tetapan gravitasi, yang ternyata besarnya sebagai massa benda dan menyatakan m sebagai massa bumi, M serta mengambil r sama dengan antara pusat benda dengan pusat bumi sebagaimana dapat dibuktikan memang demikian, berat benda B dapat ditulis dengan persamaan dibawah ini
sebagai massa benda dan menyatakan m sebagai massa bumi, M serta mengambil r sama dengan antara pusat benda dengan pusat bumi sebagaimana dapat dibuktikan memang demikian, berat benda B dapat ditulis dengan persamaan dibawah ini sebagai massa benda dan menyatakan m sebagai massa bumi, M serta mengambil r sama dengan antara pusat benda dengan pusat bumi sebagaimana dapat dibuktikan memang demikian, berat benda B dapat ditulis dengan persamaan dibawah ini
sebagai massa benda dan menyatakan m sebagai massa bumi, M serta mengambil r sama dengan antara pusat benda dengan pusat bumi sebagaimana dapat dibuktikan memang demikian, berat benda B dapat ditulis dengan persamaan dibawah ini sampai
sampai  .
.